我們圍繞“創新驅動”與“患者可及”,構建了多元化協同互補的產品組合,絕大部分產品均通過自有平臺自主開發,含多個潜在“全球新”靶點藥物,覆蓋惡性腫瘤、自身免疫系統疾病、慢性代謝類疾病、神經系統疾病以及感染性疾病這五大治療領域。
隨著產品管線的不斷豐富和對藥物聯合治療的進一步探索,我們的創新研發領域從單抗藥物擴展至包括小分子藥物、多肽類藥物、抗體藥物偶聯物(ADCs)、雙特异性或多特异性抗體藥物、核酸類藥物等更多類型的藥物研發以及癌症、自身免疫性疾病的下一代創新療法探索。
產品管線
- 腫瘤
- 自身免疫
- 慢性代謝
- 神經系統
- 感染
- 全球開發
-
JS211
PD-L1+未予披露
腫瘤
-
JS209
CD112R+TIGIT
腫瘤
-
JS208
未予披露
腫瘤
-
JS206
IL2+PD-1
腫瘤
-
JS205
EGFR+cMet
腫瘤
-
JS123
ATR
腫瘤
公司與微境生物共同開發的ATR抑製劑
-
JS122
FGFR2
腫瘤
公司與微境生物共同開發的第二代不可逆FGFR2選擇性抑製劑
-
JS121
SHP2
腫瘤
公司與微境生物共同開發的SHP2抑製劑
-
JS120
IDH1
腫瘤
公司與微境生物共同開發的第二代不可逆IDH1抑製劑
-
JS115
BCMA ADC
多發性骨髓瘤
-
JS114
Nectin4 ADC
腫瘤
-
JS104
Pan-CDK
乳腺癌等
公司與潤佳醫藥合作開發的Pan-CDK抑製劑
-
JS018
IL-2
腫瘤
公司與誌道生物合作開發的分子內二硫鍵IL-2藥物
-
JS013
CD93
腫瘤
-
JS011
未予披露
腫瘤
-
JS008
未予披露
未予披露
-
JT109
疫苗
寨卡病毒
公司與中科院微生物所合作開發的寨卡病毒疫苗
-
JT003(VV993)
3CL蛋白酶
新型冠狀病毒
靶向3CL蛋白酶的可口服抗新冠病毒候選新藥
-
JS207
PD-1+VEGF
腫瘤
-
JS203
CD3+CD20
腫瘤
公司自主研發的重組人源化抗CD20和CD3雙特異性抗體,主要用於復發難治B細胞非霍奇金淋巴瘤的治療。截至目前,國內尚無同類靶點產品獲批上市
-
JS201
PD-1+TGF-β
腫瘤
公司自主研發的能同時靶向PD-1和TGF-β的雙功能融合蛋白。截至目前,國內外尚無同類靶點產品獲批上市
-
JS116
KRAS
腫瘤
具有全新結構,用於治療KRASG12C突變的非小細胞肺癌患者
-
JS113
EGFR 4th Gen
非小細胞肺癌
公司與微境生物共同開發的潛在first-in-class第四代EGFR抑製劑,擬用於EGFR突變非小細胞肺癌和其他實體瘤的治療
-
JS112
Aurora A
小細胞肺癌
公司與微境生物共同開發的口服小分子Aurora A抑製劑。截至目前,全球尚無Aurora A抑製劑獲批上市
-
JS111
EGFR exon 20
非小細胞肺癌
公司引進的一種有效抑製EGFR非常見突變的靶向小分子抑製劑,有望給攜帶EGFR exon20插入突變等EGFR非常見突變的腫瘤患者帶來新的治療方式
-
JS110
XPO1
多發性骨髓瘤等
公司與微境生物共同開發的核輸出蛋白XPO1小分子抑製劑
-
JS108
TROP2 ADC
三陰性乳腺癌
抗腫瘤註射用重組人源化抗Trop2單抗-Tub196偶聯劑
-
JS107
Claudin18.2 ADC
消化道腫瘤
自主研發的注射用重組人源化抗Claudin18.2單克隆抗體MMAE偶聯劑
-
JS105
PI3K-α
乳腺癌 腎細胞癌
公司與潤佳醫藥合作開發的靶向 PI3K-α 的口服小分子抑製劑
-
JS101
Pan-CDK
乳腺癌等
公司自主研發的CDK抑製劑,是公司首個小分子藥物
-
JS019
CD39
腫瘤
公司與恩瑞尼生物成立合資公司共同研發的重組全人源抗CD39單克隆抗體
-
JS015
DKK1
腫瘤
JS015是公司獨立自主研發的重組人源化抗DKK1單克隆抗體註射液,主要用於晚期惡性實體瘤的治療。截至目前,國內外尚無同類靶點產品獲批上市
-
JS014
IL-21
腫瘤
公司與Anwita Biosciences共同開發的重組白介素21-抗人血清白蛋白(HSA)納米抗體融合蛋白
-
JS012
Claudin 18.2
胃癌
公司自主研發的重組人源化抗Claudin18.2單克隆抗體,擬用於治療晚期惡性腫瘤,例如胃癌及胰腺癌等
-
JS009(TAB009)
CD112R/PVRIG
腫瘤
公司自主研發的靶向CD112R的重組人源化單克隆抗體; CD112R(PVRIG)是公司發現的全新免疫檢查點通路
-
JS007
CTLA-4
肺癌 黑色素瘤
公司自主研發的重組人源化抗CTLA-4單克隆抗體注射液
-
JS006(TAB006)
TIGIT
腫瘤
公司自主研發的重組人源化抗TIGIT單克隆抗體
-
JS003
PD-L1
腫瘤
公司自主研發的人源化抗PD-L1單克隆抗體
-
JS001sc
PD-1
腫瘤
公司在特瑞普利單抗基礎上開發的皮下註射製劑
-
JS026
S蛋白
新型冠狀病毒
公司自主研發的重組全人源單克隆抗躰,主要用於COVID-19的預防和治療
-
UBP1213sc
BLyS
系统性红斑狼疮
抗BLyS單抗,用於治療系統性紅斑狼瘡和其他自身免疫系統疾病
-
JS401
ANGPTL3 (siRNA)
高脂血症
公司與潤佳醫藥共同研發的ANGPTL3 siRNA藥物
-
JS103
Uricase
高尿酸血症
公司自主研發的聚乙二醇化尿酸酶衍生物,主要用於高尿酸血癥伴或不伴有痛風的治療
-
JS010
CGRP
偏頭痛
-
貝伐珠單抗
VEGF
非小細胞肺癌
公司通過科技許可引進的VEGF單抗,擬用於治療轉移性結直腸癌和晚期、轉移性或復發性非小細胞肺癌等癌症
-
昂戈瑞西單抗
PCSK9
高脂血症
昂戈瑞西單抗公司自主研發、國內首個獲得臨床試驗批件的國產抗PCSK9單克隆抗躰,用於治療原發性高膽固醇血癥和混合型血脂異常
-
Tifcemalimab
BTLA
肺癌 黑色素瘤等
公司自主研發的全球首個進入臨床開發階段的抗腫瘤抗BTLA單抗。
-
JS005
IL-17A
銀屑病 脊柱炎
公司自主研發的特异性抗IL-17A單克隆抗躰
-
特瑞普利單抗
PD-1
腫瘤
公司自主研發、中國首個成功上市的國產抗PD-1單抗; 榮膺國家專利領域最高獎項“中國專利金獎”
-
阿達木單抗
TNF-α
類風濕關節炎等
公司與邁威生物合作開發的阿達木單抗,公司第三款商業化產品
-
氫溴酸氘瑞米德韋片
RdRp
新型冠狀病毒
新型口服核苷類抗SARS-CoV-2藥物,可抑制病毒複製
-
埃特司韋單抗
S蛋白
新型冠狀病毒
公司與中科院微生物所合作開發的重組全人源抗SARS-CoV-2單尅隆中和抗體,禮來製藥引進了該藥物在大中華區以外地區的權益,用於治療和預防COVID-19
產品詳情
- 商品名:拓益®
- 藥品代號:特瑞普利單抗
- 靶點:PD-1
- 權益:自主研發
特瑞普利單抗注射液(拓益®)作為我國批准上市的首個國產以PD-1為靶點的單抗藥物,獲得國家科技重大專項專案支持,並榮膺國家專利領域最高獎項“中國專利金獎”。
特瑞普利單抗至今已在全球(包括中國、美國、東南亞及歐洲等地)開展了覆蓋超過15個適應症的40多項由公司發起的臨床研究。正在進行或已完成的關鍵註冊臨床研究在多個瘤種範圍內評估特瑞普利單抗的安全性及療效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、腎癌及皮膚癌等。
截至目前,特瑞普利單抗已在中國獲批7項適應症:用於既往接受全身系統治療失敗的不可切除或轉移性黑色素瘤的治療(2018年12月);用於既往接受過二線及以上系統治療失敗的復發/轉移性鼻咽癌患者的治療(2021年2月);用於含鉑化療失敗包括新輔助或輔助化療12個月內進展的局部晚期或轉移性尿路上皮癌的治療(2021年4月);聯合順鉑和吉西他濱用於局部復發或轉移性鼻咽癌患者的一線治療(2021年11月);聯合紫杉醇和順鉑用於不可切除局部晚期/復發或遠處轉移性食管鱗癌患者的一線治療(2022年5月);聯合培美曲塞和鉑類用於表皮生長因數受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、不可手術切除的局部晚期或轉移性非鱗狀非小細胞肺癌的一線治療(2022年9月);聯合化療圍手術期治療,繼之本品單藥作為輔助治療,用於可切除IIIA-IIIB期非小細胞肺癌的成人患者(2023年12月)。2020年12月,特瑞普利單抗首次通過國家醫保談判,目前已有6項獲批適應症納入《國家醫保目錄(2023年)》,是目錄中唯一用於治療黑色素瘤的抗PD-1單抗藥物。
在國際化佈局方面,特瑞普利單抗已作為首款鼻咽癌藥物在美國獲得批准,其在黏膜黑色素瘤、鼻咽癌、軟組織肉瘤、食管癌、小細胞肺癌領域獲得美國食品藥品監督管理局(FDA)授予2項突破性療法認定、1項快速通道認定、1項優先審評認定和5項孤兒藥資格認定。
2022年12月和2023年2月,歐洲藥品管理局(EMA)和英國藥品和保健品管理局(MHRA)分別受理了特瑞普利單抗聯合順鉑和吉西他濱用於局部復發或轉移性鼻咽癌患者的一線治療以及聯合紫杉醇和順鉑用於不可切除局部晚期/復發或轉移性食管鱗癌患者的一線治療的上市許可申請(MAA)。2023年11月,澳大利亞藥品管理局(TGA)受理了特瑞普利單抗聯合順鉑/吉西他濱作為轉移性或復發性局部晚期鼻咽癌成人患者的一線治療,以及作為單藥治療既往含鉑治療過程中或治療後疾病進展的復發性、不可切除或轉移性鼻咽癌的成人患者的上市許可申請,特瑞普利單抗治療鼻咽癌獲得TGA授予孤兒藥資格認定。
作用机制
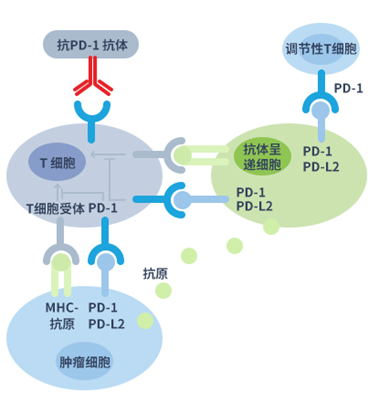
PD-1為T細胞表面受體,是T細胞共抑制信號通路的一種免疫檢查點分子。如圖下部分所示,當PD-1與腫瘤細胞表面的配體PD-L1/PD-L2結合,T細胞便接收抑制性信號。通過PD-1與其配體結合致使T細胞免疫失能並因此阻斷抗腫瘤反應。抗PD-1單克隆抗體可阻斷PD-1與PD-L1/PD-L2結合,從而使T細胞的免疫功能恢復。
主要研究文獻
- 序號 期刊名稱 文獻標題 發表時間 链接
- 1 Journal of the American Medical Association Perioperative Toripalimab Plus Chemotherapy for Patients With Resectable Non-Small Cell Lung Cancer: The Neotorch Randomized Clinical Trial 2024 打開連結
- 2 Nature Medicine Toripalimab plus nab-paclitaxel in metastatic or recurrent triple-negative breast cancer: a randomized phase 3 trial 2024 打開連結
- 3 Journal of the American Medical Association Toripalimab Plus Chemotherapy for Recurrent or Metastatic Nasopharyngeal Carcinoma: The JUPITER-02 Randomized Clinical Trial 2023 打開連結
- 4 Annals of Oncology Toripalimab plus axitinib versus sunitinib as first-line treatment for advanced renal cell carcinoma: RENOTORCH, a randomized, open-label, phase III study 2023 打開連結
- 5 Cancer Cell Toripalimab plus chemotherapy in treatment-naïve, advanced esophageal squamous cell carcinoma (JUPITER-06): A multi-center phase 3 trial 2022 打開連結
- 6 Journal of Clinical Oncology Toripalimab Plus Chemotherapy for Patients With Treatment-Naive Advanced Non–Small-Cell Lung Cancer: A Multicenter Randomized Phase III Trial (CHOICE-01) 2022 打開連結
- 7 Journal for ImmunoTherapy of Cancer Toripalimab plus axitinib in patients with metastatic mucosal melanoma: 3-year survival update and biomarker analysis 2022 打開連結
- 8 Clinical Cancer Research Safety, Efficacy, and Biomarker Analysis of Toripalimab in Patients with Previously Treated Advanced Urothelial Carcinoma: Results from a Multicenter Phase II Trial POLARIS-03 2022 打開連結
- 9 Annals of Oncology Toripalimab (anti-PD-1) versus high-dose interferon-α2b as adjuvant therapy in resected mucosal melanoma: a phase II randomized trial 2022 打開連結
- 10 Nature Medicine Toripalimab or placebo plus chemotherapy as first-line treatment in advanced nasopharyngeal carcinoma: a multicenter randomized phase 3 trial 2021 打開連結
- 11 Signal Transduction and Targeted Therapy Toripalimab plus chemotherapy as second-line treatment in previously EGFRTKIs treated patients with EGFR-mutant advanced NSCLC: a multi-center phase II trial 2021 打開連結
- 12 Journal of Clinical Oncology Efficacy, Safety, and Correlative Biomarkers of Toripalimab in Previously Treated Recurrent or Metastatic Nasopharyngeal Carcinoma: A Phase II Clinical Trial (POLARIS-02) 2021 打開連結
- 13 JAMA Network Open Safety, Antitumor Activity, and Pharmacokinetics of Toripalimab, a Programmed Cell Death 1 Inhibitor, in Patients With Advanced Non–Small Cell Lung Cancer A Phase 1 Trial 2020 打開連結
- 14 Cancer Communications A Phase I Study of Toripalimab, an anti-PD-1 Antibody, in Patients With Refractory Malignant Solid Tumors. 2020 打開連結
- 15 Clinical Cancer Research Safety, Efficacy and Biomarker Analysis of Toripalimab in previously treated advanced melanoma: results of the POLARIS-01 multicenter phase II trial 2020 打開連結
- 16 European Journal of Cancer Safety and clinical efficacy of toripalimab, a PD-1 mAb, in patients with advanced or recurrent malignancies in a phase I study 2020 打開連結
- 17 mABs Glycosylation-independent binding of monoclonal antibody toripalimab to FG loop of PD-1 for tumor immune checkpoint therapy 2019 打開連結
- 18 Acta Pharmacologica Sinica Preclinical evaluation of the efficacy, pharmacokinetics and immunogenicity of JS-001 2017 打開連結
- 19 Clinical Cancer Research Efficacy, safety and biomarkers of toripalimab in patients with recurrent or metastatic neuroendocrine neoplasms:a multiple-center phase Ib trial 2020 打開連結
- 20 Journal of Clinical Oncology Axitinib in Combination With Toripalimab, a Humanized Immunoglobulin G4 Monoclonal Antibody Against Programmed Cell Death-1, in Patients With Metastatic Mucosal Melanoma: An Open-Label Phase IB Trial 2019 打開連結
- 21 Annals of Translational Medicine JS001, an anti-PD-1 mAb for advanced triple negative breast cancer patients after multi-line systemic therapy in a phase I trial 2019 打開連結
- 22 Journal of Hematology & Oncology Safety and clinical activity with an anti-PD-1 antibody JS001 in advanced melanoma or urologic cancer patients 2019 打開連結