君实生物在中国上海成立。
君实生物成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。
凭借卓越的创新药物发现能力、先进的生物技术研发、全产业链大规模生产技术和极具市场潜力的在研药品组合,君实生物在肿瘤免疫疗法,以及自身免疫系统疾病、慢性代谢类疾病、神经系统疾病、感染类疾病等治疗方面极富潜力。
我们的使命
凭借强大的研发能力并立足医疗创新的前沿,君实生物以“用世界一流、值得信赖的创新药普惠患者”为使命。
-
为患者提供效果更好、花费更优的治疗选择
-
通过源头创新来开发首创(first-in-class)或同类最优(best-in-class)的药物
-
成为转化医学领域的先锋
-
满足医疗需求和治愈病患
发展战略
-
快速拓展产品管线
-
专注于在研药品的推进和商业化
-
提高大分子发酵产能,降低生产成本
我们致力于成为一家集研发、生产和商业化于一体,并具有全球竞争力的全产业链创新型生物制药公司。
发展历程
年份
2012
- 2025
- 2024
- 2023
- 2022
- 2021
- 2020
- 2019
- 2018
- 2017
- 2016
- 2015
- 2014
- 2012
核心团队
全球化布局
立足中国,布局全球。
君实生物从上海的全球总部出发,在中国上海、苏州和马里兰设立三个研发中心,在苏州吴江和上海临港建有两个单克隆抗体生产基地,在全球拥有三千多名员工。
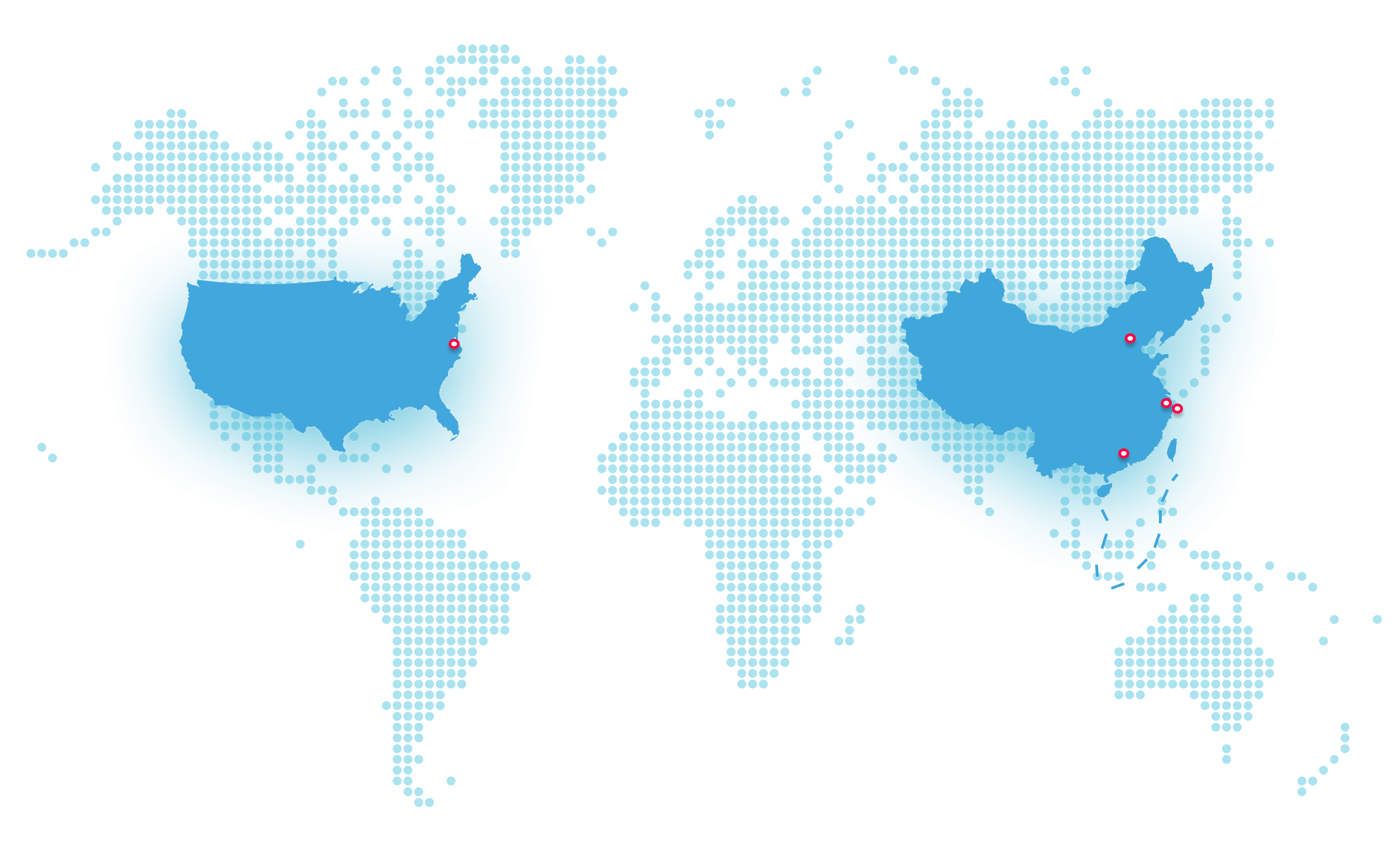
全球总部
创新研究院(上海)
- 靶点发现与验证
- 候选分子筛选与优化
- 工艺与分析方法开发
- 技术转移
- 药物注册与临床开发
上海临港生产基地
- 稳转细胞株的建立
- 工艺优化
- CGMP标准生产
- 全球质量系统的建立和维护
- 临床试验用药和商业化生产
创新研究院(苏州)
- 在研药品的功能学验证与工艺开发
- 中试生产
苏州吴江生产基地
- 稳转细胞株的建立
- 工艺优化
- GMP标准生产
- 全球质量系统的建立和维护
- 临床试验用药和商业化生产
美国研发中心
- 新靶点筛选
- 功能性抗体筛选
- 分析方法开发
- 技术转移
- 药物注册与临床开发